|
|
Навигация:
В состав газообразного топлива входят горючие и негорючие газы. Физико-химические и теплотехнические характеристики газового топлива обусловлены различием в составе горючих компонентов и наличием в газе негорючих газообразных компонентов (балластов) и вредных примесей. К горючим компонентам газообразного топлива относятся следующие вещества. Метан СН4. Бесцветный нетоксичный газ без запаха и вкуса. В состав метана входит 75% углерода и 25% водорода; 1 нм3 его имеет массу 0,717 кг. При атмосферном давлении и температуре 111 К метан сжижается и его объем уменьшается почти в 600 раз. Сжиженный метан является перспективным топливом для многих отраслей народного хозяйства. Использование и транспортирование сжиженного природного газа в ряде случаев дает большой экономический эффект, позволяет значительно снизить металлозатраты на сооружение газопроводов. И тем самым помогает решить проблемы, связанные с резервированием газоснабжения в отдельных районах страны и созданием запасов сырья для химической промышленности. Вследствие содержания в метане 25% водорода (по массе) имеется большое различие между высшей и низшей теплотой сгорания. Высшая теплота сгорания метана Q составляет 39 820 кДж/м3, 9510 ккал/м3 и 212 860 ккал/моль; низшая QH — соответственно 35 880 кДж/м3, 8570 ккал/м3 и 191 820 ккал/моль.
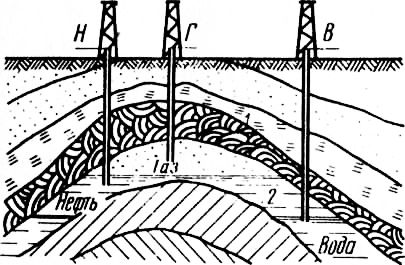
Рис. 1. Схема газонефтяного месторождения: Содержание метана в природных газах достигает до 98%, поэтому его свойства практически полностью определяют свойства природных газов. Сгорание метана в воздухе протекает но уравнению СН4 + 20г+ + 7,52N2 = C02 + 2H20 + 7,52N2 В результате сгорания образуется 10,52 нм3 продуктов горения. Метан обладает сравнительно низкой реакционной способностью. Это объясняется тем, что на разрыв четырех связей в молекуле метана требуется большая затрата энергии. Кроме метана в горючих газах могут содержаться этан С2Н2, пропан С3Н8, бутан С4Н10. Углеводороды метанового ряда имеют общую формулу СпН2п+2, где п — углеродное число, равное 1 (для метана), 2 (для этана) и 3 (для пропана) . С увеличением числа атомов в молекуле тяжелых углеводородов возрастают их плотность и теплота сгорания. Оксид углерода СО. Бесцветный газ, без запаха и вкуса; масса 1 нм3 составляет 1,25 кг; теплота сгорания 13 250 кДж/м3, 3016 ккал/нм3, или 67 590 ккал/моль. В высококалорийных газах, содержащих метан и другие углеводороды, увеличение процентного содержания оксида углерода понижает теплоту сгорания газа: 1 нм3 оксида углерода сгорает в теоретически необходимом количестве воздуха по уравнению С0 + 0,502+ 1,88N2 = C02+ 1,88N2 и образует 2,88 нм3 продуктов горения. Вследствие малого объема продуктов горения оксида углерода на каждый кубический метр их приходится больше тепла, чем на 1 м3 продуктов горения углеводородов. Поэтому продукты горения оксида углерода нагреваются до более высокой температуры, хотя теплота сгорания оксида углерода ниже, чем у углеводородов. Оксид углерода оказывает на организм человека токсическое воздействие, так как легко вступает в соединение с гемоглобином крови. В табл. 3 показано влияние оксида углерода на организм человека при различных его концентрациях в воздухе. Предельно допускаемая концентрация СО в воздухе помещения при использовании газа для коммунально-бытовых нужд составляет 2 мг/м3. Водород Н2. Бесцветный нетоксичный газ без вкуса и запаха. Масса 1 нм3 равна 0,09 кг. Он в 14,5 раза легче воздуха. Водород отличается высокой реакционной способностью, водородно-воздушные смеси имеют широкие пределы воспламенения и весьма взрывоопасны. В негорючую часть газообразного топлива входит азот и углекислый газ. Азот N2. Двухатомный бесцветный газ без запаха и вкуса. Масса 1 нм3 азота равна 1,25 кг. Атомы азота соединены между собой в молекуле тройной связью, на разрыв этой связи расходуется 170,2 тыс. ккал/моль. Теплота разрыва связи настолько велика, что взаимодействие молекулярного азота и кислорода с образованием закиси азота сопровождается затратой большого количества тепла. Азот практически не реагирует с кислородом, поэтому при расчетах процесса горения его рассматривают как инертный газ. Содержание азота в различных газах колеблется в значительных пределах. Углекислый газ С02. Бесцветный газ, тяжелый, малореакционный при низких температурах. Имеет слегка кисловатый запах и вкус. Концентрация С02 в воздухе в пределах 4…5% приводит к сильному раздражению органов дыхания; 10%-ная концентрация С02 в воздухе вызывает сильное отравление. Масса 1 нм3 С02 составляет 1,98 кг. Углекислый газ тяжелее воздуха в 1,53 раза. Углекислый газ при температуре —20 °С и давлении 5,8 МПа превращается в жидкость, которую можно перевозить в стальных баллонах. При сильном охлаждении С02 застывает в белую снегообразную массу. Твердый С02 («сухой лед») широко используется для хранения скоропортящихся продуктов. Кислород 02. Газ без запаха, цвета и вкуса. Масса 1 нм3 кислорода составляет 1,43 кг. Содержание кислорода в газе понижает его теплотворную способность и делает газ взрывоопасным. Поэтому содержание кислорода в газе не должно быть более 1% по объему. К вредным примесям относится сероводород. Сероводород H2S. Тяжелый газ с сильным и неприятным запахом, напоминающим запах тухлых яиц. Сероводород обладает высокой токсичностью. Масса 1 нм3 сероводорода равна 1,54 кг. Сероводород является газообразной кислотой и, воздействуя на металлы, образует сульфиды. Поэтому сероводород сильно корродирует газопроводы, особенно при одновременном содержании в газе H2S, Н20 и 02. При сжигании газа сероводород сгорает и образует сернистый газ, вредный для здоровья. Содержание сероводорода не должно превышать 2 г на 100 м3 газа. Все природные газы бесцветны и в большинстве своем не имеют запаха. Поэтому в случае утечки их из газопроводов в различных помещениях и сооружениях может образоваться газовоздушная смесь, которая остается незамеченной. Для того чтобы утечки газа были своевременно обнаружены, горючие газы, направляемые в городские газопроводы, одоризируют, т. е. придают им резкий специфический запах, по которому их легко обнаружить даже при незначительных концентрациях в воздухе помещений. Наиболее часто в качестве одоранта применяют этилмеркоптан. При этом запах природных топливных газов для коммунально-бытового назначения должен ощущаться при содержании 1% в воздухе. Запах сжиженных углеводородных газов должен ощущаться при содержании их в воздухе 0,5% по объему. Похожие статьи: Навигация: Статьи по теме:
Главная → Справочник → Статьи → Блог → Форум |
|
|
|
|
Информационный сайт о строительных материалах и технологиях. Контакты: Никита Королёв - © 2008-2014 |
© Все права защищены.
Копирование материалов невозможно. |
|